王勇团队发现裸子植物双黄酮合成关键酶CYP90Js,助力神经退行性疾病药物开发
神经退行性疾病已成为全球性的重大公共卫生问题,预计到2050年患者数将超过1.39亿。双黄酮(biflavonoids)是一类特殊的黄酮类二聚体,因能够同时作用于多条病理通路,在阿尔茨海默病等疾病的治疗中展现出独特优势。以银杏叶提取物 EGb 761 为代表的药物已被用于改善轻度认知障碍。但双黄酮在植物中的天然丰度极低(通常不足0.001%),严重限制了其临床应用。
2025年8月21日,国际学术期刊 Nature Communications在线发表了中国科学院分子植物科学卓越创新中心合成生物学实验室、植物性状形成与塑造全国重点实验室王勇研究组的最新成果,论文题为 “Gymnosperm-specific CYP90Js enable biflavonoid biosynthesis and microbial production of amentoflavone”。该研究首次发现裸子植物特有的细胞色素P450酶CYP90J亚家族,系统揭示了其催化双黄酮合成的分子机制与进化起源,并在微生物中实现关键双黄酮分子的从头合成。
研究团队在银杏中首次发现了一类此前未知的细胞色素 P450 酶 GbCYP90J6。该酶能够高效催化芹菜素(apigenin)在特定位点(C3’,C8”)发生分子间碳-碳键偶联,生成典型双黄酮—穗花杉双黄酮(amentoflavone)。这一发现不仅揭示了植物体内双黄酮合成的分子基础,填补了长期存在的知识空白,更是首次在植物中发现能够高效、位点特异性构建分子间碳-碳键的P450酶。
在银杏中,GbCYP90J6 与O-甲基转移酶(GbOMT1-4)协同作用,共同催化生成包括白果双黄酮(bilobetin)、银杏素(ginkgetin)和异银杏素(isoginkgetin)在内的多种双黄酮。系统发育分析与功能验证表明,CYP90J 家族起源于石松类植物的 CYP90E,并在进化过程中仅在裸子植物中保留。这一发现揭示了双黄酮合成途径的独特进化机制,表明 CYP90J 与 CYP90E 亚家族普遍具备双黄酮合成能力。
在分子机制层面,研究团队通过分子动力学(Molecular Dynamics, MD)模拟与量子/分子力学(Quantum Mechanics/Molecular Mechanics, QM/MM)计算发现,GbCYP90J6 的高度区域选择性依赖于空间构象限制与 π–π 堆叠作用,从而驱动血红素中心介导的自由基偶联反应。这一机制不仅阐明了植物体内复杂二聚反应的分子基础,也拓展了对天然产物 P450 酶功能的理解。
在应用方面,团队利用合成生物学策略,将 GbCYP90J6 等关键基因导入工程化大肠杆菌,成功重建了穗花杉双黄酮的生物合成通路,实现了从头合成,产量达到 4.75 mg/L,显著高于植物提取效率(0.059 mg/g DW),为双黄酮的低成本、规模化生产提供了新方案。
综上,该研究不仅揭示了双黄酮合成的分子机制和独特进化路径,还展示了合成生物学在天然产物药物开发中的应用潜力。未来,随着合成体系的进一步优化,双黄酮有望成为阿尔茨海默病等神经退行性疾病的新型药物资源,并为多靶点天然产物药物的研发开辟新路径。
中国科学院分子植物科学卓越创新中心与华东理工大学联合培养博士研究生代学慧为论文第一作者,王勇研究员和刘海利副研究员为共同通讯作者。该研究得到了国家重点研发计划、上海市重大科技项目的资助。
论文链接:https://doi.org/10.1038/s41467-025-62990-6
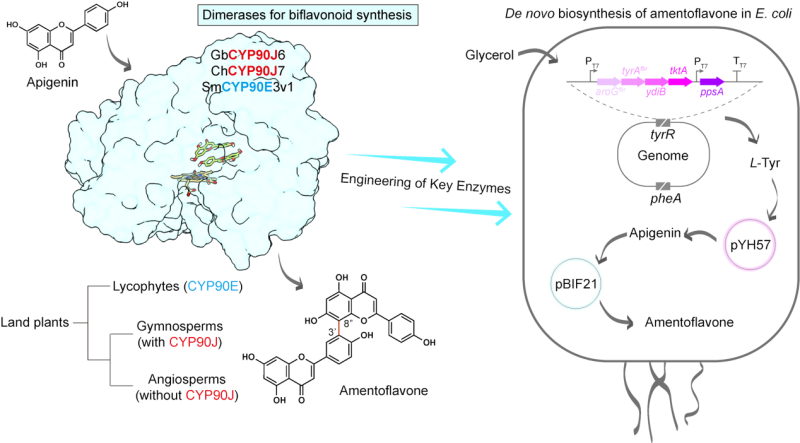
图1 裸子植物特有的 P450 酶 CYP90Js 能够高效催化芹菜素分子间特定位点的 C–C 偶联,生成穗花杉双黄酮,揭示了植物双黄酮合成的分子基础与进化起源。该合成通路已成功在工程化大肠杆菌中重建,实现了穗花杉双黄酮的从头合成。