赵清研究组在黄芩甲氧基黄酮代谢研究中取得重要进展
2021年9月7日,Plant Biotechnology Journal在线发表了中国科学院分子植物科学卓越创新中心赵清研究组题为“Two types of O-methyltransferase are involved in biosynthesis of anticancer methoxylated 4′-deoxyflavones in Scutellaria baicalensis Georgi”的研究论文。揭示了黄芩中甲氧基黄酮的合成机制。
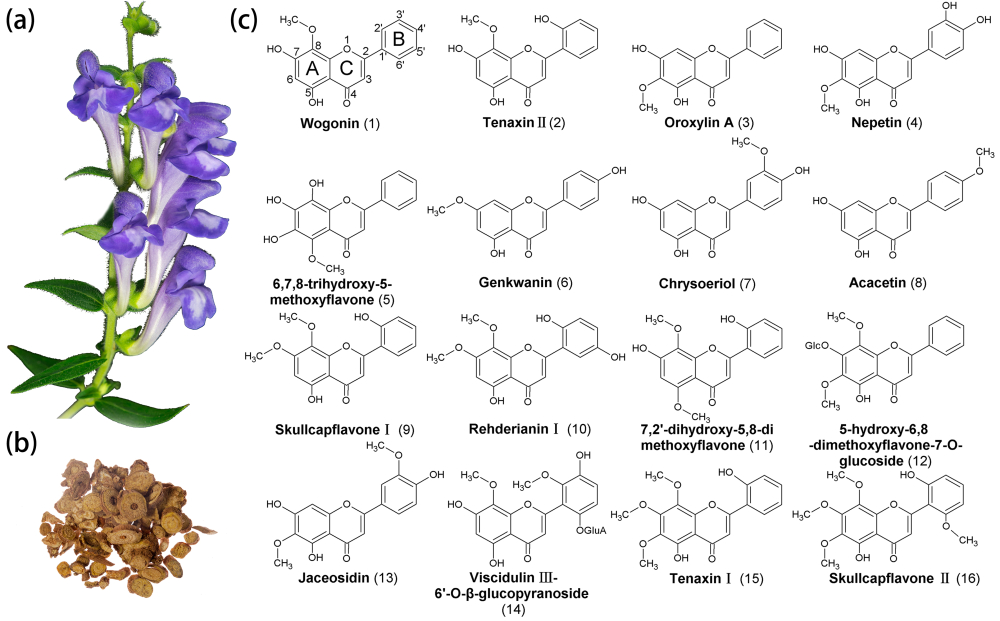
黄芩是一种重要的传统药用植物,其活性物质主要是根中结构多样的黄酮类化合物。除了常见的黄芩素、汉黄芩素以外,黄芩还含有多种甲氧基黄酮。黄酮的氧位甲基化是其基本骨架形成后的重要修饰反应,是黄酮结构及功能多样化的重要原因。研究者首先对黄芩根进行了代谢组学分析,发现其中含有72种黄酮化合物,其中甲基化黄酮占据一半以上(43种)。并将常见的甲氧基黄酮化合物:黄芩黄酮I(Skullcapflavon I)和韧黄芩素I(Tennaxin I)进行癌细胞凋亡实验,发现相对于黄芩素,黄芩黄酮I和韧黄芩素I对肝癌及肺癌细胞有更强的抗性,更低的IC50值,同时对健康细胞没有毒副作用。
进一步在黄芩中发现了两个氧位甲基转移酶(OMT)家族(I类和II类)参与黄芩根中甲氧基黄酮的生物合成。其中II类OMT家族中,根特异表达的SbPFOMT2 和 SbPFOMT5负责装饰黄酮上两个相邻羟基之一,将 C6、8 和 3'-羟基甲基化,分别形成千层纸素、韧黄芩素II和 金圣草黄素;而地上部分表达的SbPFOMT1只负责甲基化咖啡酰COA,参与木质素合成。
I类 OMT家族的SbFOMT3、SbFOMT5 和 SbFOMT6 主要负责黄酮的C7-甲氧基化。其中最为较特殊的是SbFOMT5,它除了能甲氧基化C7位,还能甲基化黄芩素中的C5和C6位羟基。进一步的蛋白建模实验,发现了SbFOMT5活性多样的原因是其核心区较大的疏水腔,能容纳黄酮分子的移动,并从两个方向插入活性中心,使得C5、C6和C7位羟基都能甲基化。将活性中心的关键几个氨基酸突变后,SbFOMT5逐渐丢失了C5、C6甲氧基化功能,该实验验证了蛋白建模的结论。
在掌握了上述两类OMT特性的基础上,研究者在酵母中共表达 SbPFOMT5 和 SbFOMT6,并添加相应羟基黄酮,该酵母生产出了黄芩黄酮 I。 而共表达SbPFOMT5 和SbFOMT5的酵母发酵产生了韧黄芩素I。这项工作表明两个 OMT 家族均参与了黄芩中甲氧基化黄酮的生物合成。
本文通过实验证明甲基化可以显著提高黄酮抑制癌细胞生长的活性,且对正常细胞没有毒性。同时找到了负责甲基化这些黄酮的酶,为后续合成生物学的研究奠定基础。
分子植物卓越中心青年研究组长赵清为通讯作者,上海辰山植物园崔孟颖为第一作者。英国John Innes Centre的Cathie Martin教授,分子植物卓越中心陈晓亚院士、杨俊研究员以及上海辰山植物园胡永红博士合作参与了该工作。该研究得到科技部国家重点研发计划,国家自然科学基金委,上海市绿化和市容管理局辰山专项的资助。
文章链接:https://onlinelibrary.wiley.com/doi/10.1111/pbi.13700