植物逆境中心朱健康研究组在植物中实现超长基因片段高效精准无赘敲入/替换编辑
2018年5月17日,国际学术期刊《Nature Communications》在线发表了植物逆境中心朱健康研究组题为“CRISPR/Cas9-mediated gene targeting in Arabidopsis using sequential transformation”的研究论文。该研究报道了一种在拟南芥中基于二代转化策略与CRISPR/Cas9系统的超长基因片段高效精准敲入/替换技术。它可以在拟南芥基因组精准定向地实现单氨基酸或大片段的插入或替换,且编辑位点无需任何标记辅助筛选,效率高达5-10%。此研究大大推进了CRISPR系统在植物中的应用,为植物基因定点编辑提供了一种新方法。
生物基因组的精准编辑是一项具有挑战性的工作,主要包括基因的敲除、敲入、替换等。近年来,CRISPR/Cas9系统在多种生物中实现了高效的基因敲除编辑。它先在基因组产生位点特异性的双链断裂(DSB),这些双链断裂再依赖细胞的两种内源机制来修复,一种是易错易突变的非同源末端连接(NHEJ),另一种是需要同源DNA模板介导的无错无差异的同源重组修复(HDR)。由于同源重组这种修复机制的发生概率较低,因此目前基因编辑领域比较高效的是造成基因突变的敲除编辑。
前期研究表明(Miki et al., 2017),双链断裂可以提高植物细胞内同源重组的效率。另外,在高等植物中,通过序列特异性核酸酶(SSN)和供体DNA的配合,初步可以实现靶标基因的敲除或敲入。但是这些技术仍有弊端,其阳性筛选都必须依赖于靶标基因附近的抗生素或除草剂抗性基因来提高效率,而这些抗性对于目的植株来说是多余的、累赘的,所以这并不是最理想的基因编辑。少数不依赖筛选标记的基因编辑效率极低,因此限制了这些技术的实用性。
朱健康研究组设计并使用由卵细胞和早期胚胎细胞特异性启动子DD45驱动的Cas9系统,“一代转化”野生型拟南芥,获得在雌性配子和早期胚胎特异表达Cas9蛋白的植株,检测并挑选出Cas9活性最高的株系作为母株。再依赖细胞内源同源重组机制,将基因特异的sgRNA元件和无需带有筛选辅助标签的目的序列DNA,“二代转化”拟南芥Cas9母株,以常规PCR和Southern印迹检测子代基因型。sgRNA元件引导Cas9定位并切割基因,目的DNA作为同源重组的修复模板,从而实现了拟南芥基因原位、精准、无缝、无累赘的改变。研究人员对2个编码拟南芥重要去甲基化酶的内源基因ROS1和DME分别进行了四个外源大片段敲入测试:在ROS1蛋白C端分别敲入720bp的绿色荧光蛋白GFP和长达1653bp的荧光素酶蛋白LUC,在DME蛋白N端和C端分别敲入GFP;同时也进行了两个单氨基酸替换测试:将DME蛋白第1633位的脯氨酸替换成丙氨酸,将DME蛋白第1648位的苯丙氨酸替换成丙氨酸。六个测试均分别获得了稳定可遗传的单株系,效率为5.3% ~ 9.1%。
本研究以二代转化策略结合CRISPR/Cas9系统,使得在高等植物基因组中敲入或替换短至数个、长至上千碱基的DNA序列片段成为可能,精准无赘,且可由常规PCR直接鉴定。该技术具有简单、高效以及部分适用性的优点,大大推动了高等植物基因编辑领域的发展,为育种生产和植物科学研究提供了新思路和新技术。
该项工作得到了中国科学院的经费支持。
文章连接:https://www.nature.com/articles/s41467-018-04416-0
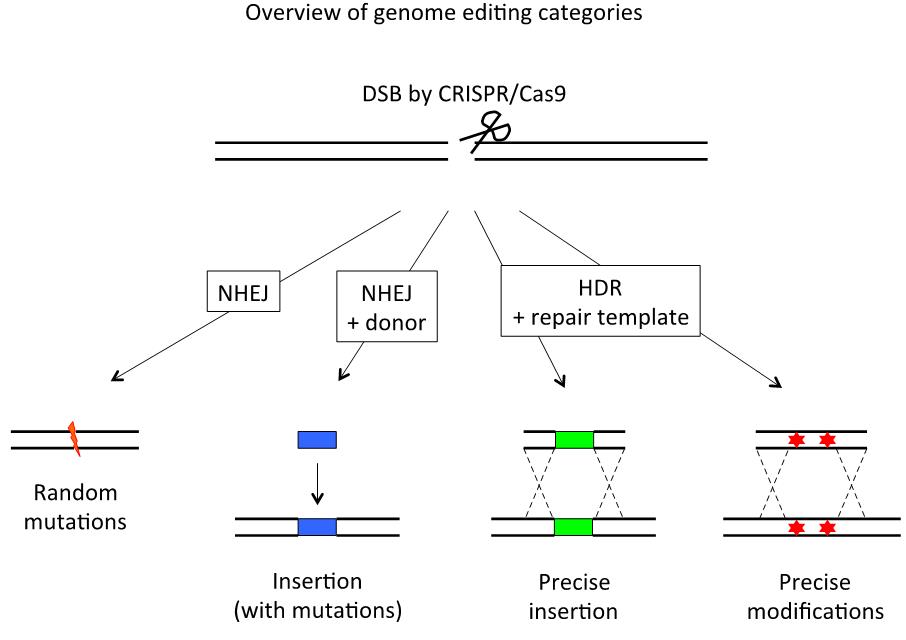
图1. DNA双链断裂细胞内源修复机制
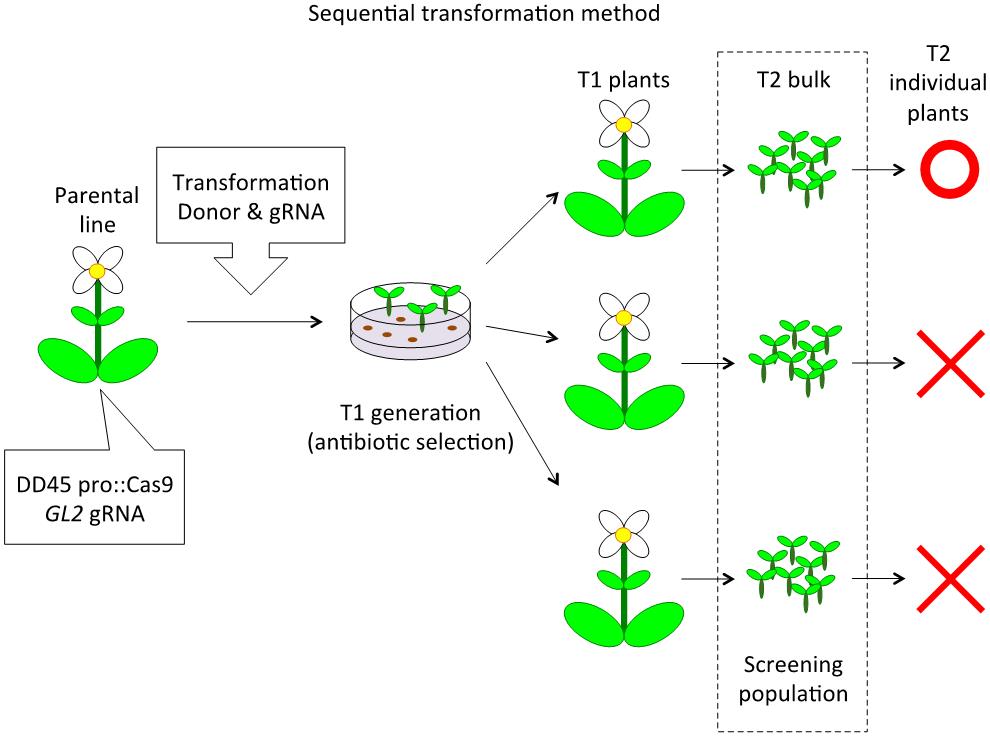
图2. 二代转化策略和阳性苗筛选流程
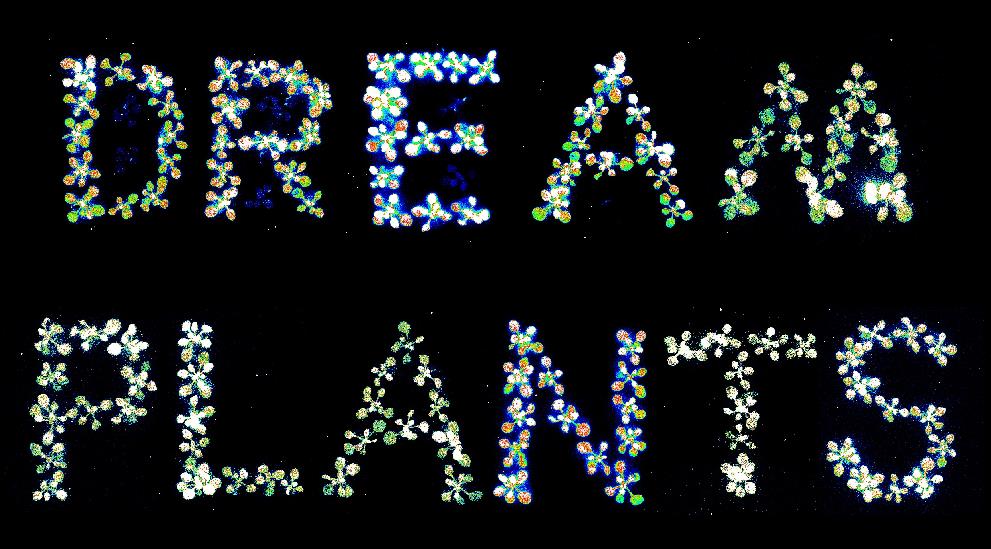
图3. 长片段敲入ROS1-LUC纯合株系幼苗荧光标语