团队协作探索光合碳代谢效率调控新机制
光合作用是光合生物利用太阳能将CO2和水转化为有机物并释放出氧气的过程,为地球上异养生命体的繁衍提供了物质保障。光合作用过程中,有机物合成的第一步是由CO2固定酶,即核酮糖-1,5-二磷酸羧化酶/加氧酶(Rubisco)所催化的。众多的研究结果表明Rubisco是光合碳同化(Calvin-Benson Cycle)途径中的关键酶,其活性决定着光合作用效率的高低。但由于Rubisco酶本身的特性,它的活力调控机制还存在许多未解之迷。
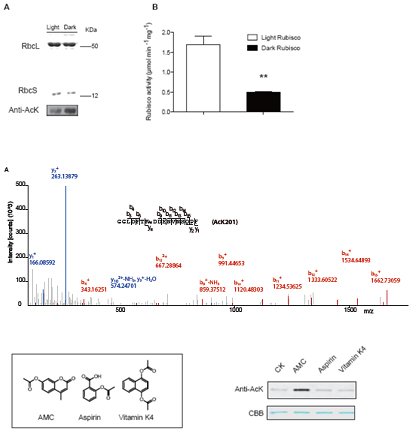
5月20日,(Molecular Plant)杂志在线发表了题为“Down-regulation of Rubisco Activity by Non-enzymatic Acetylation of RbcL”的文章,报道我所陈晓亚、陈根云、肖友利等研究组合作研究成果。他们通过解析Rubisco乙酰化修饰对其活力调控的分子机理,揭示了植物光合碳代谢效率适应体内能量状态的调控新机制。
研究发现位于Rubisco活性中心的赖氨酸残基存在乙酰化修饰,特别是201位赖氨酸(Lys201)。由于Lys201氨甲酰化是Rubisco酶发挥功能的第一步,因此Lys201乙酰化修饰必然会导致Rubisco酶功能的丧失。进一步研究表明乙酰化修饰在光反应和碳同化之间协调上扮演重要角色。基于叶绿体内不存在经典的乙酰基转移酶以及已知的乙酰基转移酶不能催化Rubisco乙酰化的事实, 他们发现植物相关代谢物的类似物,乙酰氧基香豆素(AMC) 能直接乙酰化Rubisco活性位点的赖氨酸残基,表明Rubisco酶乙酰化修饰可以由一些小分子代谢物来完成。同时,肖友利研究组以香豆素为基本骨架设计了一系列的类似物,把各种修饰基团成功地转移到了Rubisco的活性中心的相关位点,实现了对Rubisco酶活力的正负调控。这为今后提高植物光合作用效率提供了崭新的思路。
http://dx.doi.org/10.1016/j.molp.2016.03.012